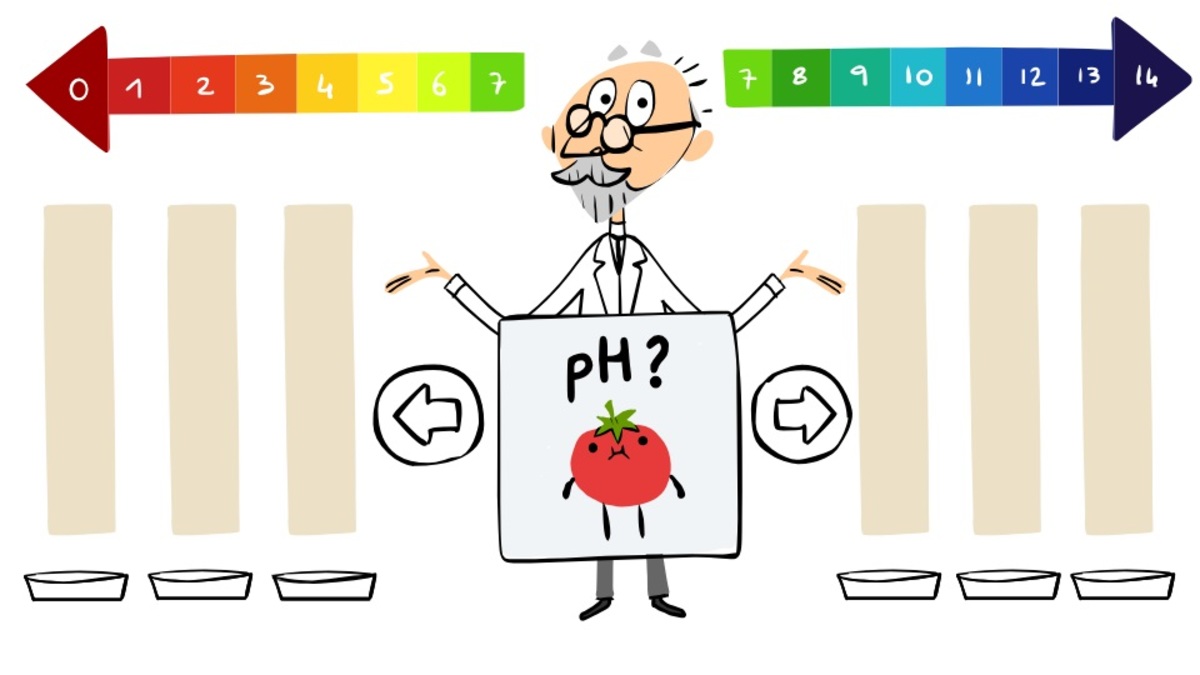
Η έννοια και η κλίμακα του pH επινοήθηκε το 1909 από το Δανό χημικό Σέρενσεν (Sören Peter Lauritz Sörensen), επικεφαλής του χημικού τμήματος του εργαστηρίου Carlsberg. H Google αφιερώνει στον Δανό χημικό το σημερινό Google Doodle. Ο S.P.L. Sörensen γεννήθηκε το 1868 και πέθανε το 1939. Ήταν Δανός χημικός και διετέλεσε διευθυντής στα εργαστήρια της ζυθοποιίας Carlsberg. Το 1909 εισήγαγε την κλίμακα pH (πε-χα) για το χαρακτηρισμό της οξύτητας ενός διαλύματος. Το επιστημονικό του έργο συμπεριλαμβάνει επίσης την ανάπτυξη αναλυτικών τεχνικών, τη σύνθεση αμινοξέων και τη μελέτη της ζύμωσης.
Η γνώση της τιμής του pH είναι πρωταρχικής σημασίας στη βιομηχανία, αναλυτική χημεία, βιοχημεία, ιατρική κλπ. Για παράδειγμα τα διάφορα υγρά στον οργανισμό μας , όπως το αίμα, το γαστρικό υγρό κλπ. θα πρέπει να έχουν περίπου σταθερό pH ή να μεταβάλλονται σε αυστηρά καθορισμένα όρια pH. Επίσης στη βιομηχανία πολλές χημικές – βιοχημικές διεργασίες γίνονται σε καθορισμένο pH και τα παραγόμενα προϊόντα πολλές φορές ελέγχονται με βάση την τιμή του pH. Ο προσδιορισμός του pH γίνεται σε πρώτη προσέγγιση με τη βοήθεια των δεικτών, που θα εξετάσουμε παρακάτω, ή ακριβέστερα με τη βοήθεια ενός οργάνου που λέγεται πεχάμετρο. Το πεχάμετρο είναι από τα πλέον δημοφιλή και απαραίτητα όργανα σε κάθε χημικό εργαστήριο.
O S.P.L. Sörensen και το pH
Η ενεργός οξύτητα ή pH (προφέρεται πεχά) είναι ένας εύχρηστος τρόπος έκφρασης της συγκέντρωσης των ιόντων υδρογόνου πιο σωστά των κατιόντων υδροξωνίου (H3O+) σε ένα υδατικό διάλυμα. Πιο συγκεκριμένα, με “pH” συμβολίζεται ο αρνητικός δεκαδικός λογάριθμος της συγκέντρωσης των ιόντων υδροξωνίου (κατιόντα υδρογόνου) στο διάλυμα.
Στους 25 °C, η κλίμακα pH κυμαίνεται από 0 έως 14 και χρησιμοποιείται ευρέως για τον προσδιορισμό της οξύτητας ενός διαλύματος. Διαλύματα για τα οποία η τιμή του pH είναι μικρότερη από 7 χαρακτηρίζονται ως όξινα, ενώ διαλύματα με pH μεγαλύτερο από 7 χαρακτηρίζονται αλκαλικά. Tέλος, τα διαλύματα με pH=7 ονομάζονται ουδέτερα. Στο διπλανό πίνακα εμφανίζονται οι τιμές του pH για τα διαλύματα ορισμένων ουσιών που χρησιμοποιούνται συχνά.
Για τα περισσότερα διαλύματα η τιμή του pH βρίσκεται κάπου ανάμεσα στο 0 και το 14, ακριβέστερα μεταξύ 1 και 13 αφού οι μετρήσεις pH στα άκρα της κλίμακας εμπεριέχουν μεγάλο βαθμό αβεβαιότητας. Παρόλ’ αυτά, ιδιαίτερα όξινα ή αλκαλικά διαλύματα είναι δυνατόν θεωρητικά να έχουν pH μικρότερο από 0 ή μεγαλύτερο από 14. Κάτι τέτοιο δεν αντιτίθεται στο μαθηματικό ορισμό του pH, το οποίο ως λογαριθμική συνάρτηση μπορεί θεωρητικά να παίρνει οσοδήποτε μικρές και οσοδήποτε μεγάλες τιμές. Για παράδειγμα, όξινο διάλυμα με συγκέντρωση των ιόντων υδροξωνίου ίση με 3 mol/L, ([H3Ο+] = 3 M) θα πρέπει να έχει pH = -0,48. Εντούτοις, αρνητικές τιμές pH αντιτίθενται στον “χημικό” ορισμό του pH και δε μπορούν να μετρηθούν με πεχάμετρο επειδή τέτοια πολύ πυκνά διαλύματα περιέχουν λίγο νερό και συνεπώς δεν είναι πλέον “υδατικά διαλύματα”.
Oι βασικοί τρόποι με τους οποίους μπορεί να μετρηθεί το pH ενός διαλύματος είναι οι εξής:
- Με τη χρήση δεικτών. Προσθέτοντας ένα δείκτη οξέος-βάσης στο διάλυμα. Οι δείκτες οξέος-βάσης (ονομάζονται και ‘ηλεκτρολυτικοί’ ή ‘πρωτολυτικοί’ δείκτες) είναι ουσίες των οποίων το χρώμα αλλάζει ανάλογα με το pH του διαλύματος στο οποίο προστίθενται.
- Με τη χρήση ενός πεχάμετρου. Το πεχάμετρο είναι μία ειδική συσκευή που χρησιμοποιεί την αρχή της ποτενσιομετρικής μέτρησης του pH (ηλεκτρομετρική μέθοδος). Το πεχάμετρο βοηθά στην περίπτωση που απαιτείται ιδιαίτερη ακρίβεια στη μέτρηση του pH.